环式电子传递(cyclic electron flow/transport, CEF/CET)是光合作用中重要的调节过程,有助于保持光合生物生长代谢所需的ATP/NADPH比例,避免光系统I(photosystem I, PSI)损伤,并通过酸化类囊体腔侧引发光保护,从而保证光合作用的高效进行。NADH脱氢酶(NDH dehydrogenase, NDH)依赖的环式电子传递(NDH-CEF)由类囊体膜上三个多亚基超大膜蛋白-色素复合物:PSI, NDH和细胞色素b6f (cytochrome b6f, Cytb6f)主要参与,这三个膜蛋白复合物之间的电子传递由位于类囊体膜内的质体醌分子(plastoquinone/plastoquinol, PQ/PQH2)和膜外的水溶性电子载体蛋白介导。NDH-CEF涉及的电子载体蛋白包括位于基质侧的铁氧还蛋白(ferredoxin, Fd)和黄素氧还蛋白(flavodoxin, Fld),以及腔侧的质体蓝素(plastocyanin, Pc)和细胞色素C6(cytochrome C6, Cc6)等(图1)。
 Fig1,类囊体膜上线性电子传递和环式电子传递路径针对光合作用相关复合物的结构生物学研究已有数十年的历史,PSI和Cytb6f的第一个高分辨率结构均在约20年前通过X-射线晶体学方法解析,此后多个不同来源的PSI和Cytb6f的结构被迅速突破,但NDH结构一直没有报道。直到近几年,得益于冷冻电镜技术的发展,蓝藻和植物NDH复合物的高分辨率(3~4.4Å)冷冻电镜结构分别于2019和2022 年被解析(图2)。比较NDH-CEF途径上三个超大膜蛋白复合物的结构,发现它们的核心亚基组成、内部电子传递链,以及涉及电子传递反应发生区域的相互作用表面在进化中高度保守,这些结构特点确保了从原核蓝藻到高等植物的光合作用的稳定功能。 Fig1,类囊体膜上线性电子传递和环式电子传递路径针对光合作用相关复合物的结构生物学研究已有数十年的历史,PSI和Cytb6f的第一个高分辨率结构均在约20年前通过X-射线晶体学方法解析,此后多个不同来源的PSI和Cytb6f的结构被迅速突破,但NDH结构一直没有报道。直到近几年,得益于冷冻电镜技术的发展,蓝藻和植物NDH复合物的高分辨率(3~4.4Å)冷冻电镜结构分别于2019和2022 年被解析(图2)。比较NDH-CEF途径上三个超大膜蛋白复合物的结构,发现它们的核心亚基组成、内部电子传递链,以及涉及电子传递反应发生区域的相互作用表面在进化中高度保守,这些结构特点确保了从原核蓝藻到高等植物的光合作用的稳定功能。
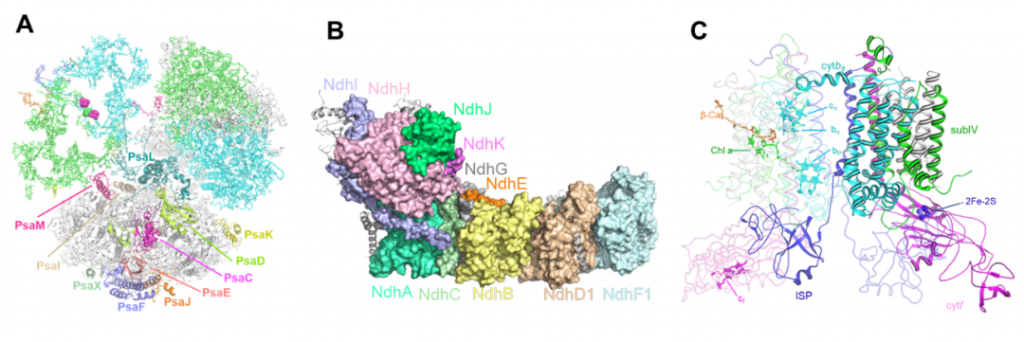 Fig.2, 蓝藻PSI(A),NDH-1L(B)和菠菜Cytb6f(C)的结构。在电子传递过程中,电子供体和受体会形成瞬时复合物,这些复合物稳定性低,不易获得,直到近几年,才有相关电子供体-受体复合物的冷冻电镜结构被报道,包括PSI-Fd、PSI-Fld、Pc-PSI-Fd及NDH-Fd,这些复合物结构为研究NDH-CEF中的电子供体-受体之间的相互作用以及结合/解离过程提供了坚实的结构基础。Fd和Fld是功能上的等位蛋白,Pc和Cc6也同为功能等效物,但是这些蛋白的差异极大,并且在进化过程中,只有Fd 和Pc在高等植物中存在,Fld 和Cc6 仅保留在原核生物和低等真核生物中。Fd和Fld的氨基酸序列和三维结构均不相同,且分别结合2Fe-2S簇和黄素单核甘酸FMN作为电子传递的辅因子,但这两个蛋白与PSI的相互作用模式一致,结合在PSI的相同位置,并都可能通过氧化还原辅因子附近的肽键翻转促使电子传递发生后的电子供体和受体解离。Pc和Cc6同样具有明显差异,且Pc结合铜离子,而 Cc6结合血色素基团作为氧化还原辅因子,它们之间的相似性和差异性与Fd和Fld之间的情况类似,Pc和Cc6均结合在PSI和Cytb6f的腔侧,且结合位点相同或相近,但由于目前只有PSI-Pc的结构信息,因而尚无法明确二者的结合位点是否完全相同。 Fig.2, 蓝藻PSI(A),NDH-1L(B)和菠菜Cytb6f(C)的结构。在电子传递过程中,电子供体和受体会形成瞬时复合物,这些复合物稳定性低,不易获得,直到近几年,才有相关电子供体-受体复合物的冷冻电镜结构被报道,包括PSI-Fd、PSI-Fld、Pc-PSI-Fd及NDH-Fd,这些复合物结构为研究NDH-CEF中的电子供体-受体之间的相互作用以及结合/解离过程提供了坚实的结构基础。Fd和Fld是功能上的等位蛋白,Pc和Cc6也同为功能等效物,但是这些蛋白的差异极大,并且在进化过程中,只有Fd 和Pc在高等植物中存在,Fld 和Cc6 仅保留在原核生物和低等真核生物中。Fd和Fld的氨基酸序列和三维结构均不相同,且分别结合2Fe-2S簇和黄素单核甘酸FMN作为电子传递的辅因子,但这两个蛋白与PSI的相互作用模式一致,结合在PSI的相同位置,并都可能通过氧化还原辅因子附近的肽键翻转促使电子传递发生后的电子供体和受体解离。Pc和Cc6同样具有明显差异,且Pc结合铜离子,而 Cc6结合血色素基团作为氧化还原辅因子,它们之间的相似性和差异性与Fd和Fld之间的情况类似,Pc和Cc6均结合在PSI和Cytb6f的腔侧,且结合位点相同或相近,但由于目前只有PSI-Pc的结构信息,因而尚无法明确二者的结合位点是否完全相同。
已有的结构数据证实了之前的推测,即膜蛋白复合物与其电子载体蛋白之间的相互作用模式相似,均由氧化还原中心附近的疏水相互作用,以及氧化还原中心外侧的静电相互作用介导。但是在进化过程中,相同电子供体-受体复合物界面处的表面电荷特征和作用细节上仍有差异。综述的最后,作者对光合作用相关复合物的结构研究进行了展望,提出未来可以进一步研究的方向,包括在NDH-CEF或其它光合作用过程中的更大的超级复合物的存在和探索。
今天跟大家分享的是十月份发表在Clinical Cancer Research杂志(IF:10.107)上的一篇文章Comparative Genomics Reveals Distinct Immune-oncologic Pathways in African American Men with Prostate Cancer,该工作对1173例未接受过放射治疗的根治性前列腺切除术样本的表达数据进行分析。首先通过使免疫特异性基因的基因表达来评估AAM和EAM前列腺肿瘤的免疫肿瘤差异,然后采用秩检验评估种族特异性差异表达基因,使用基因间相关性矩阵和基因集富集分析进行通路分析。结果发现AAM样本中显著富集了主要的免疫肿瘤通路,同时AAM TME的总免疫含量评分高于EAM,且AAM肿瘤也具有较低的DNA损伤修复和基因组放射敏感性。结果说明AAM中前列腺肿瘤具有独特的免疫系统,并显著富集了促炎免疫通路,而促炎免疫通路与较差的预后相关
 比较基因组学揭示了非裔美国男性前列腺癌患者的独特免疫肿瘤通路 比较基因组学揭示了非裔美国男性前列腺癌患者的独特免疫肿瘤通路
一、摘要种族差异的免疫肿瘤(immune-oncologic)机制在前列腺癌(PCa)中的作用仍有待研究。目前对非洲裔美国人(AAM)和欧洲裔美国人(EAM)前列腺肿瘤微环境(TME)免疫差异的分子基础研究有限。该工作使用了1173例未接受过放射治疗的根治性前列腺切除术样本。选择1260个免疫特异性基因的基因表达来评估AAM和EAM前列腺肿瘤的免疫肿瘤差异。采用秩检验评估种族特异性差异表达基因,使用基因间相关性矩阵和基因集富集进行通路分析。结果发现AAM前列腺肿瘤显著富集了主要的免疫肿瘤通路。AAM TME的总免疫含量评分(ICSHIGH)高于EAM。与EAM相比,AAM肿瘤也具有较低的DNA损伤修复和基因组放射敏感性。IFITM3是在AAM中过表达的主要促炎基因之一,它预测在发现和验证过程中选择性地增加AAM的生化复发风险,但在EAM中没有。AAM中前列腺肿瘤具有独特的免疫系统,并显著富集了促炎免疫通路,而促炎免疫通路与较差的预后相关。这种免疫肿瘤差异可以帮助以一种基因组适应的方法来治疗AAM中的PCa。
二、数据及方法1. GRIDTM样本及数据从Decipher GRIDTM registry(NCT02609269)获取1173个未接受过放射治疗的根治性前列腺切除术样本的全转录组数据和相关的临床数据。其中635个样本有前列腺癌风险评估手术(CAPRA-S)数据,即包括术前前列腺特异性抗原(PSA)、病理Gleason评分(pGS)、手术切缘(SM)、囊外扩张(ECE)、精囊浸润(SVI)和淋巴结浸润(LNI)组成的术后复发风险评分等指标(图1)。635个样本进行分析,称为“发现集”,其余的来Durham Veterans Affairs Health System的538个样本作为验证数据集(DVAHS验证集)。这项研究的主要临床结果是前列腺切除术后的生化(PSA)复发(biochemical recurrence, BCR)。从Decipher GRIDTM registry中获得了所有样本的完整转录组信息,包含约46,000个基因的mRNA表达。
2. TCGA前列腺癌数据使用TCGA中的468例前列腺肿瘤样本的RNA测序表达数据用作第二个独立验证集。血统信息基于癌症遗传血统图谱(TCGAA)。
3. 免疫基因和免疫评估根据早期文献和 HTG EdgeSeq immuno-oncology (PIP)面板定制探针集列表,共筛选出1260个与免疫功能或调控相关的基因。GRIDTM数据库还包含肿瘤免疫微环境中基因表达特征,包括Charoentong等人的Immunophenoscore(一种衡量肿瘤总体免疫原性的指标)标志,Liberzon等人的癌症信号通路标志,以及基因组放射敏感性评分。该工作使用了关键免疫细胞类型的 immunophenoscore标志,包括CD4+ T细胞(CD4+)和CD8+ T细胞(CD8+),以及免疫检查点基因程序性细胞死亡(PD)-1、PD-L2、PDL1和CTLA4。利用264个免疫细胞特异性基因的平均表达来计算推导免疫含量评分(ICS)。Zhao等人提供了ICS计算和分类的详细描述。为了进一步研究AAM前列腺肿瘤的基因组放射敏感性,结合已知的分子通路,包括hallmark DNA损伤修复,使用了经过验证的24个基因表达特征的术后放射治疗结果评分(PORTOS)和放射敏感性指数(RSI)评分。
4. 统计分析分别在发现集(n = 635)和验证集(n = 538)使用卡方检验评估各自种族群体的临床病理学特征分布。使用Mann-Whitney U检验分析AAM和EAM免疫特异基因表达差异。使用Benjamin-Hochberg 方法对P值校正,认为在发现数据集中FDR < 0.05的基因是差异表达。使用DVAHS数据集中各种族间一致差异的基因计算基因间共表达的Spearman相关性。然后这些基因用于基因集富集分析(GSEA)。使用MSigDB数据库的 HALLMARK和Reactome进行GSEA。在TCGA数据中也评估了验证过的基因在不同种族中的相对表达。最后,进一步评估了TCGA验证的基因中在top GSEA中的在发现和验证集中的预测能力,以估计种族特异性疾病进展的风险。采用种族分层Cox比例风险模型估计BCR的风险。使用Spearman相关性来评估主要免疫特征之间的相关性。
三、结果1. AAM中的免疫肿瘤通路在发现和DVAHS验证数据集中的分析流程如图1所示。首先,从Decipher GRIDTM数据库中预先识别并选择一个免疫相关基因子集,然后评估了这1260个免疫相关基因在AAM和EAM之间的相对表达情况。FDR< 0.05时,发现数据集中有54个基因以种族依赖的方式差异表达。然后在DVAHS验证数据中验证,得到其中38个基因在不同种族间存在显著差异。
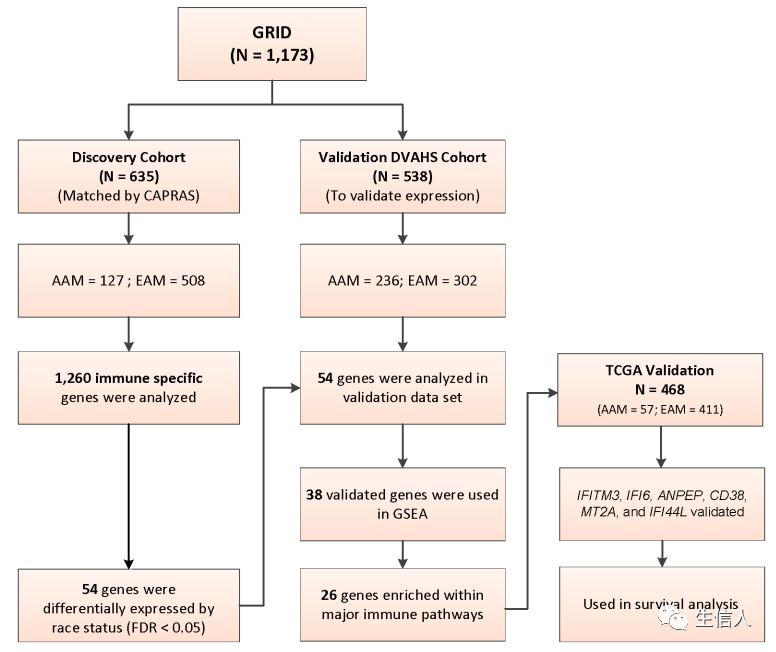 图1. 分析流程接下来对发现组和验证组中38个基因的基因间间spearman相关性进行种族分层热图分析,并使用层次聚类的生成相关性矩阵(图2A)。在两个数据集的AAM中,一致识别出一个高度相关基因的独特基因簇(图2A,红色基因)。然后使用这38个免疫特异性基因进行GSEA通路富集分析(图2B),为了识别38个差异表达基因中的富集生物学通路,使用了MSigDB中的Hallmark和Reactome基因集富集算法。GSEA Reactome分析显示,包括细胞因子信号、干扰素(IFN)信号和白介素(ILs)信号等免疫通路主要富集,GSEA Hallmark也富集了五种主要的免疫生物学通路(图2B)。在这38个基因中,在两种通路中均显著富集的有26个(图2C)。在AAM男性中高度相关基因的共表达簇在26个Hallmark和Reactome通路基因中也富集(图2C)。 图1. 分析流程接下来对发现组和验证组中38个基因的基因间间spearman相关性进行种族分层热图分析,并使用层次聚类的生成相关性矩阵(图2A)。在两个数据集的AAM中,一致识别出一个高度相关基因的独特基因簇(图2A,红色基因)。然后使用这38个免疫特异性基因进行GSEA通路富集分析(图2B),为了识别38个差异表达基因中的富集生物学通路,使用了MSigDB中的Hallmark和Reactome基因集富集算法。GSEA Reactome分析显示,包括细胞因子信号、干扰素(IFN)信号和白介素(ILs)信号等免疫通路主要富集,GSEA Hallmark也富集了五种主要的免疫生物学通路(图2B)。在这38个基因中,在两种通路中均显著富集的有26个(图2C)。在AAM男性中高度相关基因的共表达簇在26个Hallmark和Reactome通路基因中也富集(图2C)。
然后使用TCGA数据来验证这26个在主要免疫肿瘤通路中富集的基因的种族特异性差异表达。TCGA只有57例AAM,这严重限制了评估真实表达和结果的种族差异的能力。此外,TCGA中的肿瘤来自新鲜冷冻组织,在不同的基因组平台(即RNA-seq vs microarray)上进行了分析。在TCGA分析中,IFITM3、IFI6、ANPEP、CD38、MT2A和IFI44L的表达水平在AAM和EAM之间始终存在差异(图2C)。
 图2. 识别AAM中富集免疫肿瘤通路2. 依赖于种族的免疫基因和疾病进展接下来使用了上述经过TCGA验证的AAM免疫相关和种族特异性基因集进行生存分析。在Cox模型中引入了这些基因的线性表达,评估发现集和DVAHS验证数据集中BCR的风险。无论是在AAM还是EAM中,IFITM3、ANPEP、CD38、MT2A和IFI6均与BCR的风险显著相关。在两个数据集中,只有IFITM3的表达一致性地预测了AAM发生BCR的风险(图3A)。IFITM3的高表达仅在AAM中与BCR风险的增加有选择性地相关,而在EAM中并不能预测BCR风险。在DVAHS验证数据中也能得到验证。然而,其表达并不能预测EAM发生BCR的风险(图3B)。 图2. 识别AAM中富集免疫肿瘤通路2. 依赖于种族的免疫基因和疾病进展接下来使用了上述经过TCGA验证的AAM免疫相关和种族特异性基因集进行生存分析。在Cox模型中引入了这些基因的线性表达,评估发现集和DVAHS验证数据集中BCR的风险。无论是在AAM还是EAM中,IFITM3、ANPEP、CD38、MT2A和IFI6均与BCR的风险显著相关。在两个数据集中,只有IFITM3的表达一致性地预测了AAM发生BCR的风险(图3A)。IFITM3的高表达仅在AAM中与BCR风险的增加有选择性地相关,而在EAM中并不能预测BCR风险。在DVAHS验证数据中也能得到验证。然而,其表达并不能预测EAM发生BCR的风险(图3B)。
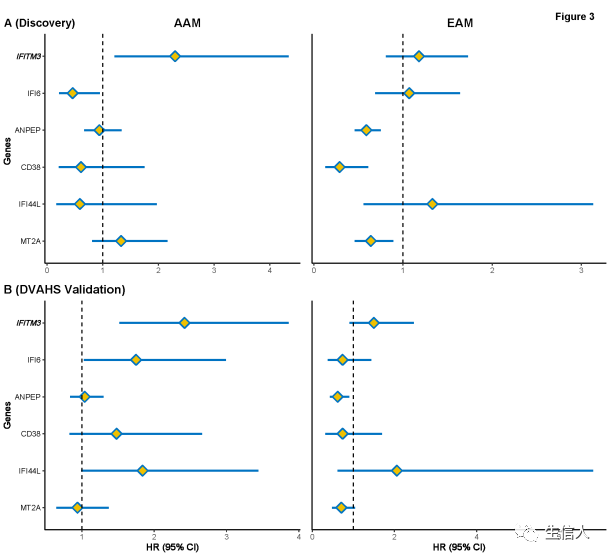 图3. 生存分析3. 免疫肿瘤特征的种族依赖性差异接下来使用GRIDTM的主要免疫细胞特征和免疫检查点蛋白(PD-1、PD- l2、PDL1和CTLA4)的基因组衍生immunophenoscore,识别了在AAM PCa中T细胞标志的选择性富集。结果表明,发现集的AAM PCa肿瘤中CD4+和CD8+的基因组中位数表达更高(图4)。AAM也有显著低水平的hallmark基因组DNA修复分数,而干扰素-α和干扰素-γ表达显著高(图4)。观察到在种族组之间其他免疫检查点标志表达没有区别。AAM肿瘤对放射更敏感,有更高的放射治疗反应。 图3. 生存分析3. 免疫肿瘤特征的种族依赖性差异接下来使用GRIDTM的主要免疫细胞特征和免疫检查点蛋白(PD-1、PD- l2、PDL1和CTLA4)的基因组衍生immunophenoscore,识别了在AAM PCa中T细胞标志的选择性富集。结果表明,发现集的AAM PCa肿瘤中CD4+和CD8+的基因组中位数表达更高(图4)。AAM也有显著低水平的hallmark基因组DNA修复分数,而干扰素-α和干扰素-γ表达显著高(图4)。观察到在种族组之间其他免疫检查点标志表达没有区别。AAM肿瘤对放射更敏感,有更高的放射治疗反应。
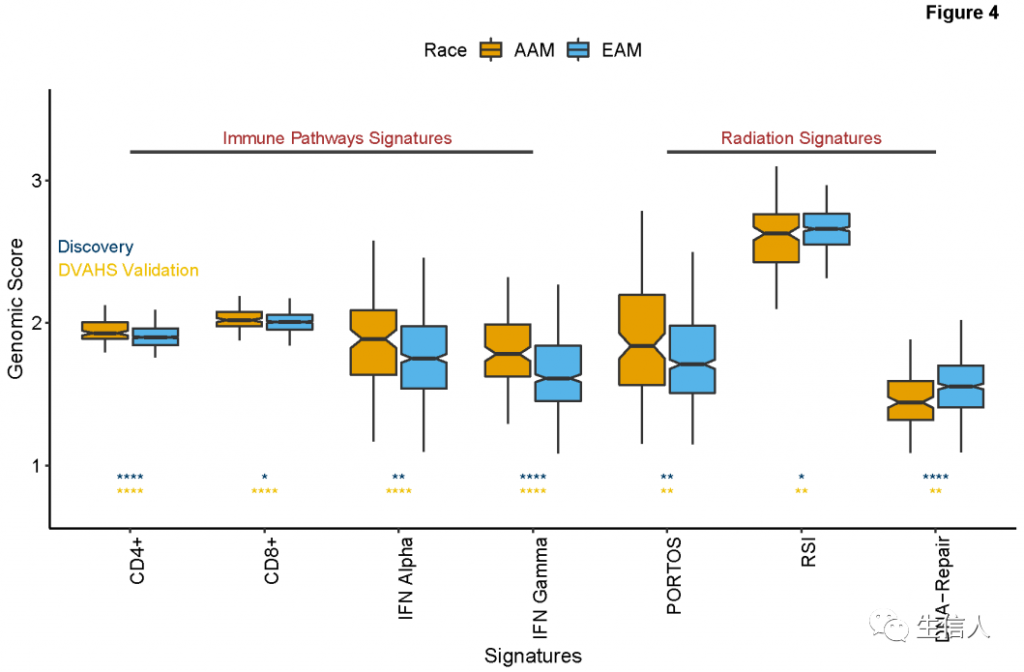 图4. 发现集中AAM和EAM的基因组特征差异在DVAHS验证数据集中,对跨种族这些发现进行了交叉验证,确认了AAM样本中CD4+、CD8+、IFN-α、IFN-γ、PORTOS、RSI和hallmark DNA修复特征的一致性关联(图4)。PORTOS和RSI与DNA修复特征的基因组相关性显示出一致的相关性(图5A-B)。此外,在这两个分析的样本群中,DNA修复评分也与CD4+和hallmark干扰素表达相关(图5C-D)。最后,发现在总免疫含量上存在显著的种族差异,37.8%的AAM具有ICSHIGH,而在EAM中只有21.9%。在验证集和TCGA集中也观察到类似的趋势,AAM PCa与EAM PCa相比,ICSHIGH的比例更高。 图4. 发现集中AAM和EAM的基因组特征差异在DVAHS验证数据集中,对跨种族这些发现进行了交叉验证,确认了AAM样本中CD4+、CD8+、IFN-α、IFN-γ、PORTOS、RSI和hallmark DNA修复特征的一致性关联(图4)。PORTOS和RSI与DNA修复特征的基因组相关性显示出一致的相关性(图5A-B)。此外,在这两个分析的样本群中,DNA修复评分也与CD4+和hallmark干扰素表达相关(图5C-D)。最后,发现在总免疫含量上存在显著的种族差异,37.8%的AAM具有ICSHIGH,而在EAM中只有21.9%。在验证集和TCGA集中也观察到类似的趋势,AAM PCa与EAM PCa相比,ICSHIGH的比例更高。
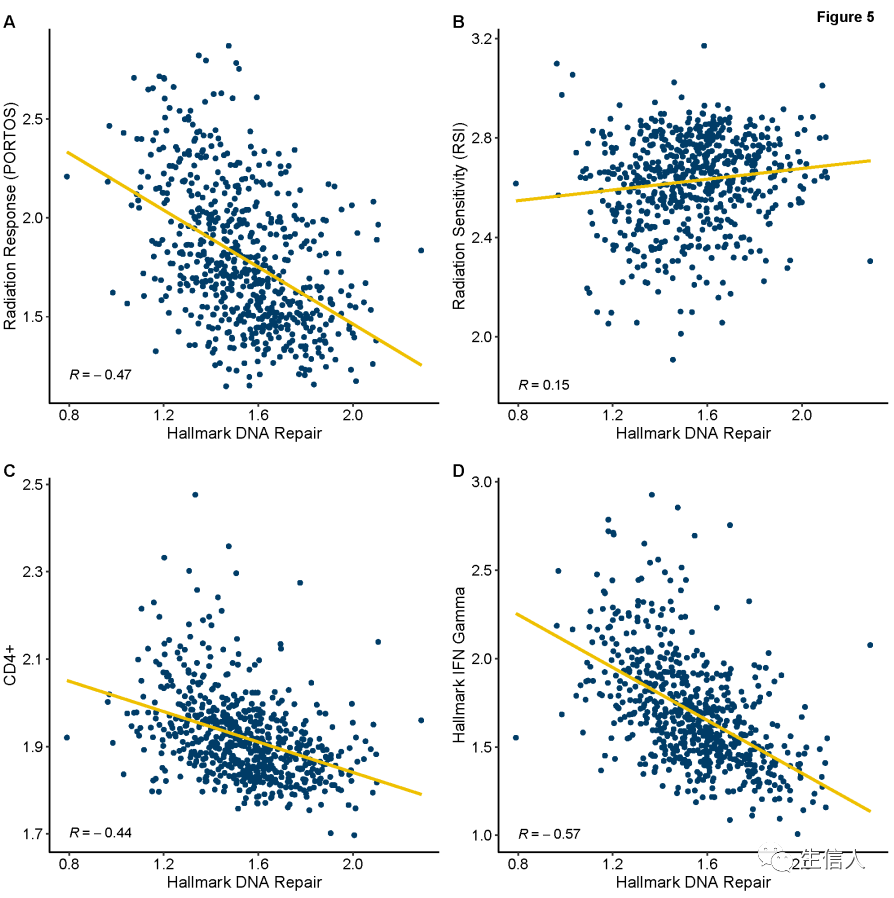 图5. 相关性分析总结:该工作使用了1173例未接受过放射治疗的根治性前列腺切除术样本的表达数据进行分析。通过使用1260个免疫特异性基因的基因表达来评估AAM和EAM前列腺肿瘤的免疫肿瘤差异,进一步的,采用秩检验评估种族特异性差异表达基因,使用基因间相关性矩阵和基因集富集进行通路分析。结果发现AAM样本中显著富集了主要的免疫肿瘤通路,同时AAM TME的总免疫含量评分高于EAM,且AAM肿瘤也具有较低的DNA损伤修复和基因组放射敏感性。发现IFITM3能够选择性地增加AAM的生化复发风险。结果说明AAM中前列腺肿瘤具有独特的免疫系统,并显著富集了促炎免疫通路,而促炎免疫通路与较差的预后相关。 图5. 相关性分析总结:该工作使用了1173例未接受过放射治疗的根治性前列腺切除术样本的表达数据进行分析。通过使用1260个免疫特异性基因的基因表达来评估AAM和EAM前列腺肿瘤的免疫肿瘤差异,进一步的,采用秩检验评估种族特异性差异表达基因,使用基因间相关性矩阵和基因集富集进行通路分析。结果发现AAM样本中显著富集了主要的免疫肿瘤通路,同时AAM TME的总免疫含量评分高于EAM,且AAM肿瘤也具有较低的DNA损伤修复和基因组放射敏感性。发现IFITM3能够选择性地增加AAM的生化复发风险。结果说明AAM中前列腺肿瘤具有独特的免疫系统,并显著富集了促炎免疫通路,而促炎免疫通路与较差的预后相关。
|
|